O uso do plasma gel como preenchedor e bioestimulador na face ganha cada vez mais espaço na Harmonização Orofacial.
Por Anderson Souza
e Roger Kirschner
A utilização de hemoderivados autólogos é uma prática consolidada na Odontologia, tanto para a correção de defeitos ósseos como de tecidos moles. No entanto, esse recurso também tem mostrado grande potencial como biomaterial preenchedor para a Harmonização Orofacial, configurando uma solução segura e de baixo custo.
O uso do plasma rico em plaquetas (PRP) e do plasma rico em fatores de crescimento derivado de plaquetas (PDGF) vem demonstrando efeitos positivos em inúmeros tratamentos, como patologias inflamatórias, ortopédicas, reumatológicas e diversos tratamentos odontológicos. Os produtos derivados do PRP têm demonstrado eficácia na regeneração tecidual, com modulação da resposta inflamatória, indução na síntese de colágeno e dos componentes da matriz extracelular, além de estimular a vascularização local1.
O termo “PRP” é frequentemente empregado para caracterizar uma solução de plasma obtida a partir do sangue total, com elevadas concentrações de plaquetas quando comparado ao sangue total2. Uma vez que as plaquetas são ativadas, a solução torna-se enriquecida em ampla variedade de fatores de crescimento, além das proteínas plasmáticas3.
O principal elemento no PRP de interesse na biomodulação tecidual aplicado à estética refere-se às plaquetas. Produzidas na medula óssea, as plaquetas são produto da fragmentação citoplasmática do megacariócito (célula da medula óssea) e possuem aproximadamente 2 micrômetros em diâmetro, com vida útil de sete a dez dias4.
A principal função plaquetária é garantir a hemostasia sanguínea. Entretanto, estudos científicos têm mostrado que as plaquetas contêm mais de 800 proteínas com numerosas modificações pós-tradução, resultando em mais de 1.500 fatores bioativos à base de proteína5. Entre as diversas propriedades plaquetárias, conhecemos seus efeitos anti-inflamatórios e analgésicos e a secreção de peptídeos antimicrobianos6.
O conhecimento de suas propriedades moduladoras e estimuladoras de proliferação das linhagens de células estaminais mesenquimais, torna o PRP um excelente produto autólogo como um elemento auxiliar útil para melhorar a regeneração tecidual e promover a neocolagênese7. O PRP atraiu a atenção no âmbito estético como um tratamento coadjuvante para o rejuvenescimento facial, alopecias e estimulação para renovação tecidual2.
Alguns estudos focados na restauração da integridade tecidual têm mostrado a função das plaquetas no processo de cicatrização das feridas: durante a fase de inflamação e de coagulação, a formação de um coágulo sanguíneo induz adesão, agregação e degranulação de plaquetas circulantes8. Os grânulos plaquetários, cujo conteúdo é formado por diversas substâncias, que são liberadas no momento da ativação, promovem restauração da integridade tecidual8. Entre as principais substâncias liberadas durante a ativação plaquetária, estão os fatores de crescimento, as citocinas, as moléculas de adesão, as integrinas e as proteínas que participam na coagulação2.
A obtenção do PRP
Atualmente, existe uma grande variedade de protocolos para obtenção e preparo do PRP, e todos envolvem as etapas básicas de preparação que seguem inicialmente à venopunção e coleta do sangue, centrifugação, aspiração do plasma, uma segunda centrifugação em maior força gravitacional, remoção do sobrenadante e ressuspensão do pellet de plaquetas no volume plasmático residual, seguido de ativação e posterior aplicação9 (Figuras 1).
Vários fatores podem afetar o produto final do PRP, como temperatura, força e tempo de centrifugação, sequência e número de centrifugações, uso de anticoagulação e mecanismos de ativação das plaquetas, uma centrifugação mais longa e vigorosa sedimenta a camada leucoplaquetária reduzindo as plaquetas no sobrenadante plasmático, resultando em menor concentração de fatores de crescimento no plasma final10.
Venopunção: coleta em sistema fechado
O processamento do sangue humano para obtenção do PRP em sistema fechado (sistema a vácuo) e a manipulação do sangue para a obtenção da fibrina rica em plaquetas (PRF) podem ser realizados em centro cirúrgico ou consultório odontológico por cirurgião-dentista devidamente habilitado, em conformidade com a RDC/Anvisa no 63/2011. O processamento do sangue humano em sistema aberto para obtenção de PRP para uso autólogo em Odontologia deverá ser realizado exclusivamente em Centros de Tecnologia Celular (CTCs), devidamente licenciados pela vigilância sanitária competente nos termos da legislação vigente e mediante acordo entre os serviços por meio de documento escrito que comprove terceirização11. A Resolução no 158 do Conselho Federal de Odontologia, publicada em 8 de junho de 2015, versa sobre o uso de produtos autólogos considerando a necessidade de regulamentação do uso de agregados plaquetários autólogos para fins não transfusionais no âmbito da Odontologia. Confira alguns destaques do documento:
“… considerando ser o Plasma Rico em Plaquetas (PRP) a porção do sangue que contém os componentes plaquetários, com a adição de qualquer produto, inclusive anticoagulante ou coagulante; e considerando ser Fibrina Rica em Plaquetas (PRF) a porção do sangue que contém os componentes plaquetários, sem adição de qualquer produto, inclusive anticoagulante ou coagulante, resolve:
Art. 1o – Reconhecer e regulamentar o uso de Agregados Plaquetários Autólogos para uso exclusivamente autólogo, não transfusional, na prática odontológica (Plasma Rico em Plaquetas e Fibrina Rica em Plaquetas).
§ 1o – Fica autorizada a realização de venopunção para obtenção de Agregados Plaquetários Autólogos para uso exclusivo em Odontologia pelo cirurgião-dentista, devidamente habilitado ou de profissional de saúde devidamente habilitado em conjunto e corresponsabilidade com o cirurgião-dentista.
§ 2o – Para fins de comprovação de qualificação e capacitação em venopunção para obtenção de Agregados Plaquetários Autólogos poderão ser apresentados diplomas, declarações, certificados e congêneres.
§ 3o – O processamento do sangue humano para obtenção do Plasma Rico em Plaquetas (PRP) em sistema fechado e a manipulação do sangue para a obtenção da Fibrina Rica em Plaquetas (PRF) podem ser realizados em centro cirúrgico ou consultório odontológico por cirurgião-dentista devidamente habilitado, em conformidade com a RDC/Anvisa no 63/2011 ou a que vier a substituí-la ou complementá-la.
§ 4o – O processamento do sangue humano em sistema aberto, para obtenção de Plasma Rico em Plaquetas (PRP) para uso autólogo em Odontologia, deverá ser realizado exclusivamente em Centros de Tecnologia Celular (CTCs), devidamente licenciados pela vigilância sanitária competente nos termos da legislação vigente e mediante acordo entre os serviços por meio de documento escrito que comprove terceirização.”
Assim, toda a coleta destinada ao uso do PRP e seus derivados deverá ser realizada em sistema de coleta a vácuo, garantindo a esterilidade do sangue coletado. A técnica é segura, por reduzir o risco de exposição do tecido sanguíneo e também é possível coletar volume considerável em uma única venopunção12.
Esse sistema de coleta de sangue possui uma agulha de duplo bisel em ambas as extremidades, uma delas recoberta por um manguito de borracha que é acoplado a um dispositivo de inserção do tubo, que permite que não ocorra contato com o sangue, e a outra extremidade é exclusivamente para venopunção13. É considerado venopunção em sistema aberto quando a coleta é realizada com seringa e agulha, onde se faz necessária a desconexão da agulha para transferir o sangue ao tubo de coleta, assim havendo contato com ambiente13. A coleta em sistema fechado permite o processamento da amostra biológica sem qualquer contato do sangue com o meio externo utilizando o método de centrifugação por força gravitacional14.
Para obtenção do sangue periférico, utiliza-se preferencialmente as veias basílica e cefálica na região da fossa antecubital do braço, sítio com baixo índice de riscos associados à venopunção, como a flebite15. Para realizar antissepsia do sítio de punção, utiliza-se a solução de álcool etílico a 70% isoladamente, sendo um método eficiente para descontaminação da região16. Utiliza-se torniquete para evidenciar a veia para venopunção e liberar somente após o preenchimento do primeiro tubo para coleta do sangue periférico, não sendo indicada a permanência do torniquete por períodos acima de um minuto, a fim de reduzir potenciais erros devido à estase venosa prolongada – o que pode alterar a quantidade de plaquetas obtidas durante a venopunção17. O método utilizado para coleta do sangue compreende o sistema a vácuo para se manter a esterilidade do sangue e obter o sangue necessário em menor tempo para garantir as proporções fisiológicas de seus elementos figurados18. A coleta é realizada em tubos de 4 mL contendo 0,5 mL de citrato de sódio a 3,8%.
Processamento do sangue
Após a coleta do sangue, realiza-se a segregação do mesmo em PRP, concentrado de hemácias e camada leucoplaquetária, utilizando o protocolo de Ley-Díaz19 modificado. Um exemplo: 21,6 mL de sangue total coletado são distribuídos em seis tubos com volume total de 3,6 mL, com anticoagulante citrato de sódio a 3,2%. Os tubos são centrifugados no primeiro ciclo por 1.400 rpm a sete minutos, a fim de manter uma concentração de plaquetas superior à fisiológica, e uma segunda centrifugação de 2.000 rpm é realizada por dez minutos19.
Descrição da técnica de obtenção do plasma gel
1. Venopunção: obtenção de oito tubos de 4 mL de sangue – tubo de ensaio de TPA azul com anticoagulante citrato de sódio a 3,8%;
2. Centrifugação leve do sangue: 1.400 rpm por sete minutos para separar o PRP das hemácias;
3. Visualização do “BUFF COAT”: camada leucoplaquetária, na cor branca;
4. Após a primeira centrifugação, realiza-se a aspiração e a transferência do PRP do tubo centrifugado (parte amarela) a um tubo de ensaio seco, de 9 mL, com tampa vermelha (não tem substância adicional no tubo), usando uma seringa de 10 mL;
Segunda centrifugação: mais pesada, para separar o plasma pobre – 2.000 rpm por dez minutos. Essa centrifugação promove a separação entre o pellet de plaquetas e o plasma pobre em plaquetas (PPP), que deverá ser separado para a desnaturação e a formação do plasma gel como preenchedor. O pellet de plaquetas no fundo do tubo corresponde à camada leucoplaquetária;
5. Um pouco mais que a primeira metade do tubo, após essa centrifugação, corresponde ao plasma pobre, e é removido em uma seringa de 10 mL para depois ser utilizado como volumizador. A segunda metade do tubo de ensaio corresponde ao PRP. Faz-se a ressuspensão das plaquetas, homogeneizando manualmente.
Segue-se com a adição de 100 uL de cloreto de cálcio a 10% em 1 mL de PRP, com o objetivo de fornecer cálcio, a fim de promover a cascata de coagulação e a formação da fibrina;
6. O PRP deve ser incubado a 37º por 30 minutos para promover a formação do trombo branco e a consequente liberação dos fatores de crescimentos derivados de plaquetas no sobrenadante2020. O soro com fatores de crescimento será o indutor biológico para fibroblastos, neocolagênese e angiogênese;
7. O plasma pobre é incubado por cinco minutos a 90º na própria seringa. Esse material é o plasma gel ou o preenchedor (volumizador; Figura 2);
8. Mistura o PRP líquido (10% da quantidade da seringa) com o PPP geleificado (0,8 mL de PRP para cada 8 mL de PPP) para controlar a viscosidade do gel. A quantidade é visual. O PDGF pode ou não ser misturado ao plasma gel, se ele for misturado fornece fatores de crescimento (Figuras 3).
Formação do plasma gel
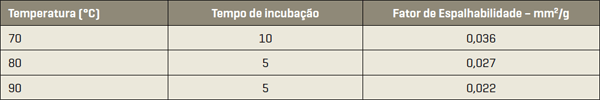
Para a modificação do PPP em plasma gel, devemos alterar alguns parâmetros de textura do plasma sanguíneo, que são obtidos por diferentes variáveis como temperatura, pH e concentração de proteínas, sendo a melhor forma de manter as características de pH e interação entre as proteínas, o aquecimento com variação de 70ºC a 90ºC. O plasma gel pode ser descrito como um estado intermediário (Figuras 1) entre uma solução e um precipitado, garantindo o equilíbrio entre proteína-proteína e proteína-solvente, conforme o tempo e a temperatura, promoverá a perda de umidade, e sua agregação e desnaturação proteica começam a 55ºC21.
Após a separação do PPP em uma seringa de 5 mL, realizam-se incubações seriadas de 37º, 70º e 90ºC para desnaturação e geleificação do PPP. O cálculo para Fator de Espalhabilidade (Fe) corresponde à relação entre a área de espalhamento conseguida com a aplicação de esforço sobre o produto. O resultado é expresso em mm2/g, considerando que por esforço limite se entende o peso em gramas das placas a partir do qual o produto não mais espalha mesmo quando se aplica mais esforço. Com isso, esse teste baseia-se na resistência ao movimento forçado e os resultados com relação ao plasma gel estão descritos na Tabela 122. A espalhabilidade (Ei) é determinada a 25ºC através da equação:
Ei = d2 x π / 4
Considerando:
Ei: espalhabilidade da amostra para o peso em milímetro quadrado (mm2).
d: diâmetro médio (mm).
Preparo do plasma gel rico em fatores de crescimento derivado de plaquetas
Após a incubação do PPP para a relação ideal proteína-proteína no plasma gel, enriquecemos o material obtido com PDGF, utilizando um dispositivo em torneira de três vias Luer Lock para a transferência ao plasma gel, homogeneizando o volume de 2 mL do PDGF a 5 mL de plasma gel para posterior preenchimento em camada dérmica23.
Uso do plasma gel em Harmonização Orofacial
Os preenchimentos faciais injetáveis mais populares incluem o ácido hialurônico e o colágeno bovino. Apesar de suas conhecidas vantagens, o alto custo e a possibilidade de intercorrências com a sua aplicação por vezes desencorajam clínicos e pacientes a realizarem procedimentos mais extensos com tais produtos. A busca por preenchedores menos arriscados e de melhor custo-benefício estimulou a introdução dos implantes autólogos, incluindo a gordura e o colágeno para o aumento tecidual e a bioestimulação. No entanto, esses materiais demonstraram alguns problemas, tais como a morbidade no local doador e a dificuldade no controle do volume do tecido adquirido.
Materiais autólogos mais convenientes, seguros e baratos – como o gel de plasma – têm sido estudados com o objetivo de oferecer soluções de preenchimento e bioestimulação viáveis e seguras do ponto de vista clínico. Nos últimos anos, o gel de plasma ganhou popularidade na cirurgia plástica, ortopédica, oral e vários outros campos, na tentativa de superar a gordura autóloga10. Atualmente, o gel de plasma autólogo tem sido empregado como preenchimento dérmico para correção estética de rugas faciais e ptoses teciduais.
A modificação do PPP pela adição de um ativador de cascata de coagulação, como o gluconato de cálcio 10%, ou o cloreto de cálcio a 10%, a trombina e/ou o tratamento térmico, dá origem a um material gelatinoso conhecido como “gel de plasma” ou “plasma gel”. Esse material contém fibrina – que fornece à fórmula maior consistência e resistência do que o plasma rico em plaquetas (PRP líquido). Adicionalmente, a adição de gluconato de cálcio promove níveis mais altos de liberação imediata e maciça de fatores de crescimento através da formação do trombo plaquetário. As plaquetas trabalham através da degranulação de seus α-grânulos, que contêm fatores de crescimento pré-sintetizados. Os fatores de crescimento mais potentes são: fator de crescimento derivado de plaquetas (PDGF), fator de crescimento transformador beta (TGF-beta), fator de crescimento de insulina (IGF), fator de crescimento endotelial vascular (VEGF) e fator de crescimento endotelial (EGF). O processo de aquecimento induz a desnaturação das proteínas plasmáticas que mantém a fórmula do gel e, subsequentemente, permite a injeção de uma quantidade precisa no local desejado.
É importante ressaltar que a fórmula do gel serve como veículo para os seus fatores de crescimento adicionados posteriormente. Os fatores de crescimento aprisionados no gel de plasma injetado continuam sua ação bioativa após a injeção e interagem com as células mesenquimais indiferenciadas e os fibroblastos dérmicos, ligando-se a seus receptores celulares específicos que promovem neo-vascularização e neocolagênese, resultando em aumento dos tecidos moles e redução da profundidade das rugas.
A grande vantagem da Odontologia frente às demais áreas da saúde é a possibilidade da prática de venopunção pelos cirurgiões-dentistas que possuem habilitação, além do uso legalizado dos produtos autólogos pelo Conselho Federal de Odontologia. Na Medicina e na Biomedicina, o uso desses produtos é permitido apenas experimentalmente, em pesquisas vinculadas a grandes centros de ensino.
Referências
1. Moreira V. Uso do plasma rico em plaquetas no processo de revascularização endodôntica. Brazilian Journal of health Review 2018;1(1):70-80.
2. Monteiro MR. Plasma rico em plaquetas em dermatologia. Surgical Cosmetic Dermatology 2013;5(2):155159.
3. Lynch M, Bashir S. Applications of platelet-rich plasma in dermatology: A critical appraisal of the literature. J Dermatolog Treat 2016;27(3):285-9.
4. Dhurat R, Sukesh M. Principles and methods of preparation of platelet-rich plasma: A review and author′s perspective. J Cutan Aesthet Surg 2014;7(4):189-97.
5. Boswell SG, Cole BJ, Sundman EA, Karas V, Fortier LA. Platelet-rich plasma: a milieu of bioactive factors. Arthroscopy 2012;28(3):429-39.
6. Amable PR, Carias RB, Teixeira MV, da Cruz Pacheco I, Corrêa do Amaral RJ, Granjeiro JM, et al. Platelet-rich plasma preparation for regenerative medicine: optimization and quantification of cytokines and growth factors. Stem Cell Res Ther 2013;4(3):67-80.
7. Rodríguez Flores J, Palomar Gallego M, Torres García-Denche J. Plasma rico en plaquetas: fundamentos biológicos y aplicaciones en cirugía maxilofacial y estética facial. Revista Española de Cirugía Oral y Maxilofacial 2012;34(1):8-17.
8. Leo MS, Kumar AS, Kirit R, Konathan R, Sivamani RK. Systematic review of the use of platelet-rich plasma in aesthetic dermatology. J Cosmet Dermatol 2015;14(4):315-23.
9. Abu-Ghname A, Perdanasari AT, Davis MJ, Reece EM. Platelet-Rich Plasma: Principles and Applications in Plastic Surgery. Semin Plast Surg 2019;33(03):155-61.
10. Araki J, Jona M, Eto H, et al. Optimized preparation method of platelet-concentrated plasma and noncoagulating platelet-derived factor concentrates: maximization of platelet concentration and removal of fibrinogen. Tissue Eng Part C Methods 2012;18(03):176-85.
11. Resolução CFO nº 158, de 08-06-2015 – DOU 06-07-2015.
12. Andriolo A. Recomendações da Sociedade Brasileira de Patologia Clínica Medicina Laboratorial para coleta de sangue venoso. 2. ed. Barueri: Manole, 2010.
13. Organização Mundial de Saúde. Diretrizes da OMS para a tiragem de sangue: boas práticas em flebotomia. Disponível em: <www.who.int/infection-prevention/publications/Phlebotomy-portuges_web.pdf>. Acesso em: 16 out. 2019.
14. Anitua E, Troya M, Pino A. A novel protein‐based autologous topical serum for skin regeneration. J Cosmet Dermatol. 2019 Aug 9. doi: 10.1111/jocd.13075. [Epub ahead of print].
15. Nobre ASP, Martins MDS. Prevalência de flebite da venopunção periférica: fatores associados. Rev. Enf. Ref. [online]. 2018;IV(16):127-38.
16. Fonseca LG, et al. Evaluation of skin antisepsis of blood donors by four methods. Rev Bras Hematol Hemoter 2009.
17. Nikolac N, et al. Croatian Society of Medical Biochemistry and Laboratory Medicine: national recommendations for venous blood sampling. Biochemia Medica 2013;23(3):242-54.
18. Guimarães AC, et al. O laboratório clínico e os erros pré-analíticos. J Bras Patol Med Lab 2009. Disponível em: <http://lilacs.bvsalud.org/>. Acesso em: 16 out. 2019.
19. Díaz-Ley B, Cuevast J, Alonso-Castro L, Calvo MI, Ríos-Buceta L, Orive G, et al. Benefits of plasma rich in growth factors (PRGF) in skin photodamage: Clinical response and histological assessment. Dermatol Ther 2015;28(4):258-63.
20. Abu-Ghname A, Perdanasari AT, Davis MJ, Reece EM. Platelet-Rich Plasma: Principles and Applications in Plastic Surgery. Semin Plast Surg. 2019;33(3):155-161.
21. Hermansson AM. Gel Characteristics-Structure as Related to Texture and Waterbinding of Blood Plasma Gels. Journal of Food Science 1982;47(6):1965-72.
22. Zanin, et al. Physicals parameters in the emulsion stability study. Revista Visão Acadêmica, Curitiba, 2001;2(2):47-58.
23. Anitua E, Troya M, Pino A. A novel protein-based autologous topical serum for skin regeneration. Journal of Cosmestic Dermatology 2019. DOI: 10.1111/jocd.13075.